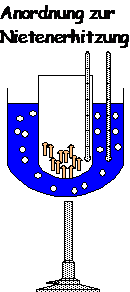
Die Ausgangslage
Wir haben 3
verschiedene Sorten von Nieten zur Verfügung, von denen wir die Wärmekapazität
berechnen möchten. Zur Verfügung sind dafür:
>
Die
Nieten
>
Eine
Waage
>
Ein
Kalorimeter
>
Ein
Barometer
>
Verschiedene
Thermometer
>
Ein
Wasserbad mit siedendem Wasser
>
Ein Gefäß,
in welchem die Nieten erhitzt werden können.
>
Ein
Rührer, um das Wasser zu durchmischen
Die Vorgehensweise
Bestimmung
der Wärmekapazität des Rührers und des Kalorimeters (Nachschauen im Buch Formel
und Tafeln)
Messen
der Masse der Nieten
Erhitzen der Nieten auf die
Siedetemperatur des Wassers, ohne dabei die Nieten ins Wasser zu werfen. Dafür
werden die Nieten in einen Behälter gegeben, der dann in ein Wasserbad getaucht
wird.
Ablesen
des Luftdruckes, der dann anhand einer Tabelle unter Berücksichtigung der
Temperatur berichtigt wird
Ablesen
der Siedetemperatur des Wassers, der anhand einer Tabelle unter
Berücksichtigung des Luftdruckes berichtigt wird.
Wasser
ins Kalorimeter geben. Zuerst wird dann die Masse des Wassers berechnet, aus
der vorher schon bestimmten Masse des Kalorimeters. Danach wird die Temperatur
jede Minute gemessen, auf einem Zeitraum von etwa 10 Minuten.
Wenn die
Nieten sich bis auf die Siedetemperatur des Wassers erhitzt haben, werden sie
ins Kalorimeter gegeben. Die Temperatur wird wiederum gemessen, nun aber in
Abständen von 10 Sekunden.
Nach der
letzten Messung ist das Experiment beendet, und der Arbeitsplatz kann
aufgeräumt werden.
2. Theorie
2.1
Begriffe und Variablen
Kalorimeter Gerät, von dem man
die genaue Wärmekapazität kennt.
Wärmekapazität Angabe,
wieviel Energie benötigt wird, 1kg des Stoffes um 1 °C zu erwärmen
Barometer Gerät zum Messen
des Luftdruckes
mNieten Masse der Nieten
CNieten Wärmekapazität der
Nieten
Tsied Siedetemperatur des Wassers
Tm Temperatur gemessen
mKalorimeter Masse des Kalorimeters
2.2
Formel zur Berechnung des Experimentes
mNieten *
CNieten * ( TNieten - Tm ) = mKalorimeter * Ckalorimeter
* ( Tm - T0 ) +
MWasser * CWasser *( Tm
- T0 )
Das hier ist die
allgemeine Form zur Berechnung von Wärmekapazitäten. Nach der Auflösung der
Formel nach CNieten kann die Wärmekapazität einfach berechnet
werden.
3. Das
Experiment
3.1
Messdaten
Masse des
Kalorimeters mit dem Rührer, leer 164,82
g
Masse des
Kalorimeters mit dem Rührer, gefüllt mit Wasser 474,50g
Wärmekapazität des
Kalorimeters 383
J/Kg* °k
Wärmekapazität
desWassers 4182
J/Kg* °k
Masse des Wassers 309.68
g
Masse der Nieten 40,29
g
Luftdruck abgelesen 731
Torr
Zimmertemperatur 24,2
°C
Korrigierter
Luftdruck mit Hilfe der Tabelle 731-3
= 728 Torr
Siedetemperatur des
Wassers bei 728 Torr Luftdruck 98,798
°C