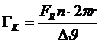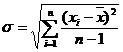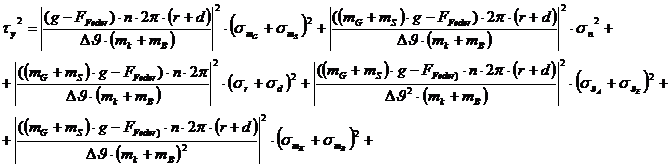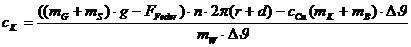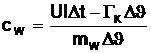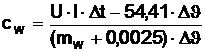Grundpraktikum I
Spezifische
Wärmekapazität
Versuchsaufgabe
Um
die spezifische Wärmekapazität von Kupfer und Wasser zu bestimmen standen uns
zwei verschiedene Wege zur Verfügung. Einerseits durch alleinige Zufuhr
mechanischer Arbeit andererseits durch zufuhr elektrischer Arbeit. Um die
spezifische Wärmekapazität von Wasser bestimmen zu können, muss zuerst die
spezifische Wärmekapazität von Kupfer aus dem das Kalorimeter besteht bestimmt
werden.
Im Versuch
ermittelte Größen:
Temperatur
 [°C]
[°C]
Massen mi
[g]
Spannung
U [V]
Strom I
[A]
Umdrehungen
n [1]
Zeit t
[s]
Radien r [mm]
Verwendete Messgeräte
Thermometer
Präzisionsbalkenwaage
Schiebelehre
Stoppuhr
Volt-
bzw. Amperemeter
Federwaage
Grundlagen
Der
erste Hauptsatz der Wärmelehre Q
=  U - W
U - W
Die
dem System netto zugeführte Wärme Q ist die Differenz der Anderung seiner
inneren Energie und der von ihm verrichteten Arbeit W.
Das ist nichts anders als eine Formulierung des
Energieerhaltungssatzes. Wird dem System Wärme zugeführt, so kann seine innere
Energie erhöht werden, oder das System kann Arbeit verrichten, oder beides.
In unserem beiden versuchen wird dem System auf
zwei verschiedene arten Wärme zugeführt. Einmal durch mechanische und einmal
durch elektrische Arbeit.
Bestimmung der spezifischen Wärmekapazität auf mechanischem
Weg
Die
hierzu verwendete Apparatur nennt man Schnürholz-Apparat und ist unter 3.1.3.1
in "Praktikum der Physik [W. Walcher]" skizziert.
Im Optimalfall dreht man nun die Kurbel gerade
so schnell, dass die Feder entspannt wird und somit das Gewicht über dem Boden
schwebt. [Daran scheiterten wir aber, und deshalb mussten wir die Feder mit
einer Zugkraft von ca. 3 N Spannen.] Dabei entsteht durch die Reibung Wärme,
die an das Kalorimetergefäß (bzw. das Kupferband) abgegeben wird. Es wird eine
konstante Temperaturverteilung im Kalorimeter und im Kupferband angenommen.
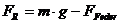
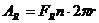
Die
Reibungswärme bewirkt, dass sich das Kalorimeter mit der Anfangstemperatur 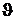 A auf die Endtemperatur
A auf die Endtemperatur 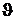 E erwärmt.
E erwärmt.
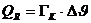
Daraus
die Wärmekapazität des Kupfers
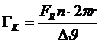
bzw.
die spezifische Wärmekapazität des Kupfers ausgerechnet werden:
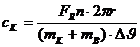
Nachdem
nun die Wärmekapazität von Kupfer und damit die Wärmekapazität des Kalorimeters
bekannt ist, kann der Versuch mit Wasser wiederholt werden. Dazu wird ein
hohles Kalorimetergefäß mit destilliertem Wasser gefüllt.
Die
Reibungsarbeit errechnet sich komplett gleich wie oben beschrieben. Die
abgegebene Wärmemenge führt allerdings nun zu einer Erwärmung des Kalorimeters
und des Wassers:
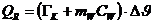
Da
die Reibungsarbeit gleich der aufgenommen Wärmemenge ist, ergibt sich die
spezifische Wärmekapazität des Wassers zu:
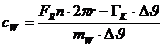
Aufgaben und Auswertung
Messdaten:
Masse des
Kupferzylinders: mK
= 735,0g 0,05g
Masse des
Kupferbandes: mB
= 22,95g 0,05g
Masse der
Schnur: mS
= 31,2g 0,05g
Masse des
Gewichts: mG
= 5kg 0,05g
Radius
des Zylinders: r = 32mm 0,1mm
Dicke des
Kupferbandes: d= 1mm 0,1mm
Raumtemperatur: 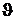 U = 23,4°C 0,5°C
U = 23,4°C 0,5°C
|
Messgrößen mit Einheiten
|
1.Versuch
|
2.Versuch
|
3.Versuch
|
|
Umdrehungen n [1]
|
|
|
|
|
Zeit t [s] [°C]
|
360s 1s
|
360s 1s
|
360s ± 1s
|
|
Anfangstemperatur D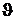 A [°C] A [°C]
|
20,0°C ± 0,1
|
19,0°C ± 0,1
|
19,0°C ± 0,1
|
|
Endtemperatur D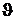 E [°C] E [°C]
|
29,4°C ± 0,1
|
28,2°C ± 0,1
|
28,3°C ± 0,1
|
|
Temperaturdifferenz D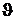 [°C] [°C]
|
9,4°C
|
9,2°C
|
9,3°C
|
Jetzt
kann die spezifische Wärmekapazität des Kupfers berechnet werden:
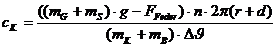
Mit
Hilfe der molaren Masse des Kupfers, kann nun die molare Wärmekapazität des
Kupfers bestimmt werden.
Molare
Masse von Kupfer (ersichtlich im Periodensystem) :
MCU = 63,546 g/mol
Mit
der Zahl der Mole kann die molare Wärmekapazität bestimmt werden
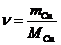 T
T 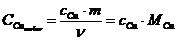
Wärmekapazität
zu:
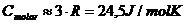
Fehlerrechnung:
Mittelwert
In unserem Versuch ergibt sich der Mittelwert zu:
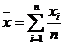 wobei n gleich
der Anzahl der Versuche ist
wobei n gleich
der Anzahl der Versuche ist
Standardabweichung
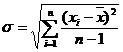
Vertrauensbereich:
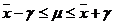
wobei 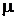 der wahre Wert der
Messgröße ist.
der wahre Wert der
Messgröße ist.
Die Vertrauensgrenze beträgt:
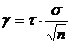
Bei drei Versuchen und unter Ansatz eines
Vertrauensniveaus von 95% ergibt sich 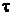 aus Tabelle A 1.5,
Walcher Seite 395
aus Tabelle A 1.5,
Walcher Seite 395
Relativer
Vertrauensbereich:
ist der Vertrauensbereich bezogen auf den Mittelwert
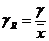
Größtfehler
Der Größtfehler ist die Summe der Absolutwerte der
Einzelfehler:

Beim ersten Beispiel ergibt sich der Größtfehler zu:
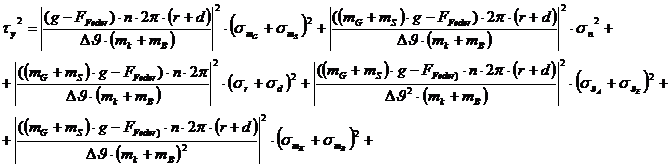
Der Größtfehler ist für alle drei Versuche ungefähr
gleich groß.
(112,91 - 109,90 - 113,56) J/kg.K
Ergebnisse für die spezifische Wärmekapazität von Kupfer:
|
Größe mit Einheit
|
Versuch 1
|
Versuch 2
|
Versuch 3
|
|
Spezifische Wärmekapazität ccu [J/kg.K]
|
|
|
|
|
Mittelwert
|
533,1 J/kg.K
|
|
Standardabweichung
|
9,28 J/kg.K
|
|
Absoluter Vertrauensbereich
|
23,04 J/kg.K
|
|
Relativer Vertrauensbereich
|
|
|
Größtfehler
|
ca. 112,2 J/kg.K
|
Sollwerte (Dippler):
ccu = 386 J/kg.K
cmolar = 24,5 J/mol.K
Ergebnisse für die molare Wärmekapazität von Kupfer:
|
Größe mit Einheit
|
Versuch 1
|
Versuch 2
|
Versuch 3
|
|
Molare Wärmekapazität cmolar [J/mol.K]
|
|
|
|
|
Wert nach Dulong-Petit
|
24,9 J/mol.K
|
|
Mittelwert
|
44,11 J/mol.K
|
|
Standardabweichung
|
0,78 J/mol.K
|
|
Absoluter Vertrauensbereich
|
1,94 J/mol.K
|
|
Relativer Vertrauensbereich
|
|
Wärmekapazität des Wassers
Anstatt
des Kalorimetergefäßes aus dem vorigen Versuch, wird jetzt ein hohles
Kalorimetergefäß aus Kupfer verwendet, dass zu Begin mit einer bestimmten Menge
destillierten Wassers gefüllt wird. Für die Wärmekapazität von Kupfer wurde für
die weitere Berechnung der Sollwert (Dippler) eingesetzt da unser Wert sehr
ungenau ist.
Die
Wärmekapazität des Wassers errechnet sich aus:
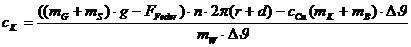
Messdaten:
Masse des
Kupferzylinders: mK = 108,6g 0,05g
Masse des
Kupferbandes: mB
= wie oben
Masse der
Schnur: mS
= wie oben
Masse des
Gewichts: mG = wie
oben
Radius
des Zylinders: r = wie oben
Dicke des
Kupferbandes: d= wie
oben
Raumtemperatur:  U = wie oben
U = wie oben
|
Messgrößen mit Einheiten
|
1.Versuch
|
2.Versuch
|
3.Versuch
|
|
Masse des Wassers
|
56,15g ± 0,05g
|
|
Umdrehungen n [1]
|
|
|
|
|
Zeit t [s] [°C]
|
360s 1s
|
360s 1s
|
360s ± 1s
|
|
Anfangstemperatur D A [°C] A [°C]
|
20,0°C ± 0,1
|
20,0°C ± 0,1
|
20,0°C ± 0,1
|
|
Endtemperatur D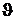 E [°C] E [°C]
|
27,8°C ± 0,1
|
27,2°C ± 0,1
|
29,3°C ± 0,1
|
|
Temperaturdifferenz D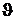 [°C] [°C]
|
7,8°C
|
7,2°C
|
9,3°C
|
Ergebnisse für die spezifische Wärmekapazität von Wasser:
|
Größe mit Einheit
|
Versuch 1
|
Versuch 2
|
Versuch 3
|
|
Spezifische Wärmekapazität ccu [J/kg.K]
|
|
|
|
|
Mittelwert
|
7594 J/kg.K
|
|
Standardabweichung
|
552,7 J/kg.K
|
|
Absoluter Vertrauensbereich
|
1372 J/kg.K
|
|
Relativer Vertrauensbereich
|
|
Sollwert (Dippler):
cW = 4,18 kJ/kg.K
cmolar = 75,2 J/mol.K
Bestimmung der spezifischen Wärmekapazität von Wasser auf
elektrischem Weg
Zur
Bestimmung der Wärmekapazität wird der Aufbau wie in 3.1.3.2 in "Praktikum der Physik [W. Walcher]"
verwendet. Das abgewogene Wasser wird in einem möglichst gut isolierten Gefäß,
durch einen Tauchsieder, dessen Strom und Spannungsabfall mit einem Ampere- und
einem Voltmeter gemessen wird, auf elektrischen Weg erwärmt.
Die
aufgewendete elektrische Arbeit ergibt sich zu:
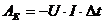
Die
dem Kalorimeter zugeführte Wärmeenergie beträgt:
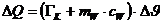
Zufolge
der Energieerhaltung ergibt sich die spezifische Wärmekapazität des Wasser zu:
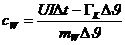
Auch
bei diesem Versuch gibt es Verluste, z.B. durch den Innenwiderstand des
Voltmeters, die wir aber vernachlässigten.
Aufgaben und Auswertung
Das
hierbei verwendete Kalorimeter ist nicht aus Kupfer, wie bei den ersten beiden
Versuchen sondern aus Aluminium.
Messdaten 1. Versuch:
Masse des
Wassers: mW =
232,5g 0,05g
Anfangstemperatur: 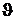 A = 32,6°C 0,1°C
A = 32,6°C 0,1°C
Endtemperatur: 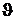 E = 54,7°C 0,1°C
E = 54,7°C 0,1°C
Temperaturdifferenz: D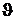 = 22,1°C
= 22,1°C
Spannung: 5,4 V 0,1V
Strom: 4,6 A 0,1A
Zeit: t =
1320s 1s
Spannung
und Strom wurden während des gesamten Versuches gemessen. Es stellt sich
heraus, dass die beiden Werte als konstant angenommen werden können.
Berechnung:
Zunächst
müssen die Wärmekapazitäten verschiedener Bauteile berechnet werden:
Wärmekapazität
des Kalorimetergefäßes:
Das Kalorimetergefäß (m = 49,5 g) besteht aus
Aluminium. Die spezifische Wärmekapazität von Aluminium beträgt 897 J/kg.K
(Tabellenwert - Dippler).
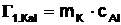 = 53,282 J/K
= 53,282 J/K
Wärmekapazität
der Heizwendel mit Zubehör:
Laut Angabe entspricht die Wärmekapazität der
Heizwendel, der Zuleitungen und des Rührers zusammen der von 2,5g Wasser.
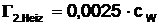
Gesamte
Wärmekapazität:
 53,282 J/K
53,282 J/K
Die spezifische Wärmekapazität ergibt sich zu:
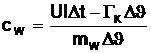
Ersetzt man nun die Wärmekapazität des Kalorimeters, so erhält man:
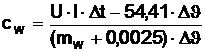
Die Fehlerrechnung ist gleich wie bei der Ermittlung der spezifischen
Wärmekapazität von Wasser auf mechanischem Wege.
Ergebnisse für die
spezifische Wärmekapazität von Wasser:
|
Größe mit Einheit
|
Versuch 1
|
|
Spezifische Wärmekapazität ccu [J/kg.K]
|
|
Da es uns zeitlich nicht mehr möglich war, diesen Versuch noch 2 mal zu
wiederholen, kann der Mittelwert (mit Standardabweichung) und der
Vertrauensbereich (absolut und relativ) nicht berechnet werden.
Sollwert
(Dippler):
cW = 4,18 kJ/kg.K
T/t -
Diagramm
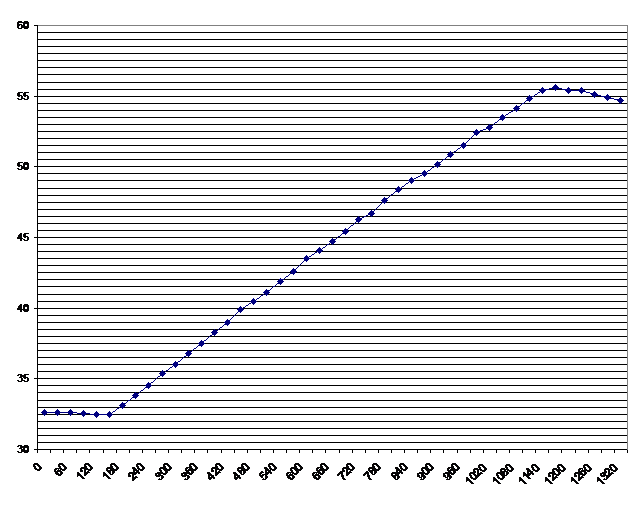
x-Achse: Sekunden
y-Achse: Grad Celsius
Anhang - Messdaten
|
Versuch mit Elektrizität
|
|
s
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
Heizung
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s
|
Kalorimeter aus Vollkupfer
|
|
|
|
|
|
C
|
Umdrehungen [n]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kalorimeter (Hohl) gefuellt mit H2O
|
|
|
|
|
|
|
|
s
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|